“ Alphafold 3:革新分子結構和相互作用預測”
自2020年推出以來,已有超過200萬研究人員使用Google DeepMind的AlphaFold 2預測蛋白質結構,助力疫苗開發與癌症治療等突破。該模型解決了困擾科學家半世紀以上的難題。但Google DeepMind團隊未止步於此;他們未沉醉於榮譽,而是捲起袖子開始研發AlphaFold 3。
由Google DeepMind與Isomorphic Labs於五月推出,AlphaFold 3更上一層樓。它不僅預測蛋白質摺疊,還能預測各種生命分子的結構與相互作用,包括DNA、RNA和配體——那些與蛋白質結合的微小分子。
「有了AlphaFold 2,我們在解決蛋白質摺疊難題上取得了巨大進展,但科學界已轉向更複雜的問題,」Google DeepMind研究科學家Jonas Adler解釋。「研究人員現在深入探討小分子如何結合,或RNA如何運作等AlphaFold 2無法勝任的領域。為了跟上生物學與化學的最新進展,我們需要一款能處理各種生物分子的工具。」
這裡的「一切」包括配體,因其構成約一半的藥物而至關重要。「在Isomorphic Labs,我們看到AlphaFold 3在理性藥物設計上的巨大潛力,我們已每天應用它,」Isomorphic Labs研究領導者Adrian Stecula說。「我們正在探索新小分子如何與新藥靶點結合,研究蛋白質與DNA、RNA的相互作用,以及化學調整如何影響蛋白質結構——新模型開啟了所有這些可能性。」
納入這些額外的分子類型意味著要處理更多的組合。「蛋白質相對簡單,只有20種標準氨基酸,」Jonas指出。「但小分子?它們無處不在,可能性無窮。它們極其多樣。」
意識到全面資料庫不可行,團隊推出了AlphaFold Server。這款免費工具讓科學家輸入自己的序列,AlphaFold為其生成分子複合物。自五月上線以來,已用於創建超過100萬個結構。
「這就像是分子複合物的Google Maps,」Google DeepMind研究工程師Lindsay Willmore說。「即使你不是程式設計師,也只需複製貼上你的蛋白質、DNA、RNA或小分子序列,按下按鈕,等幾分鐘,就能得到結構以及信心度量,幫助你評估預測的準確性。」
為了讓AlphaFold 3適用於如此廣泛的生物分子,團隊擴展了訓練數據,包括DNA、RNA、小分子等。「我們想,『為什麼不利用數據集中幫助我們研究蛋白質的所有內容,看看能走多遠?』」Lindsay解釋。「結果,我們走得很遠。」
AlphaFold 3的關鍵變化在於生成結構的最後部分。AlphaFold 2使用了複雜的幾何模組,而AlphaFold 3改用基於擴散的簡單生成模型,類似於其他先進的圖像生成模型如Imagen。這一變化簡化了模型處理新型分子的方式。
然而,這一轉變帶來了新挑戰:擴散模型會錯誤地為實際上「無序」的蛋白質區域創建「有序」結構——就像試圖將一堆混亂的義大利麵整理成整齊的螺旋。
因此,團隊轉向AlphaFold 2,其擅長預測這些無序相互作用。「我們用AlphaFold 2的預測來訓練AlphaFold 3,教它識別和預測無序,」Lindsay說。
「我們有句話:『相信螺旋麵,拒絕直麵,』」Jonas笑著補充。
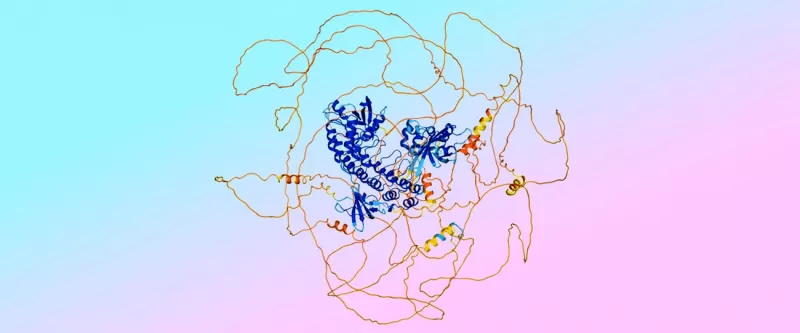
來自AlphaFold 3的預測示例,顯示藍色的有序「螺旋麵」區域和橙色的無序「直麵」區域。顏色表示模型對預測準確性的信心。
團隊期待看到AlphaFold 3在基因組學和藥物設計等領域的應用。「看到我們走了多遠,真是令人驚嘆,」Jonas說。「曾經困難的現在變得簡單,曾經不可能的現在觸手可及。仍有難題待解,但我們對AlphaFold 3能幫助我們實現的感到興奮。」
 「Dot AI 伴侶應用程式宣布關閉,停止個人化服務」
根據 Dot 開發商於週五發佈的公告,Dot 將停止營運。Dot 背後的新創公司 New Computer 在其網站上表示,這項服務將持續提供至 10 月 5 日,讓使用者有時間匯出個人資料。此應用程式於今年初由共同創辦人 Sam Whitmore 與前 Apple 設計專家 Jason Yuan 合作推出。Dot 進入日益受到關注的情感 AI 伴侶領域,將自己定位為可適應的數位朋友,可根據使用者
「Dot AI 伴侶應用程式宣布關閉,停止個人化服務」
根據 Dot 開發商於週五發佈的公告,Dot 將停止營運。Dot 背後的新創公司 New Computer 在其網站上表示,這項服務將持續提供至 10 月 5 日,讓使用者有時間匯出個人資料。此應用程式於今年初由共同創辦人 Sam Whitmore 與前 Apple 設計專家 Jason Yuan 合作推出。Dot 進入日益受到關注的情感 AI 伴侶領域,將自己定位為可適應的數位朋友,可根據使用者
 Anthropic 解決 AI 產生盜版書籍的法律案件
Anthropic 已與美國作家就一宗重大版權糾紛達成和解,同意擬議的集體訴訟和解方案,以避免可能耗費巨資的審判。該協議於本週二在法庭文件中提交,源於該人工智能公司使用盜版文學作品訓練其 Claude 模型的指控。雖然此案源於作家 Andrea Bartz、Charles Graeber 和 Kirk Wallace Johnson 的訴訟,但和解細節仍然保密。他們於 2023 年提出訴訟,指控
Anthropic 解決 AI 產生盜版書籍的法律案件
Anthropic 已與美國作家就一宗重大版權糾紛達成和解,同意擬議的集體訴訟和解方案,以避免可能耗費巨資的審判。該協議於本週二在法庭文件中提交,源於該人工智能公司使用盜版文學作品訓練其 Claude 模型的指控。雖然此案源於作家 Andrea Bartz、Charles Graeber 和 Kirk Wallace Johnson 的訴訟,但和解細節仍然保密。他們於 2023 年提出訴訟,指控
 Figma 向所有用戶發佈 AI 驅動的應用程式生成工具
Figma Make 是今年初推出的創新提示應用程式開發平台,目前已正式退出測試版,並向所有使用者推出。這個突破性的工具加入了 Google 的 Gemini Code Assist 和 Microsoft 的 GitHub Copilot 等人工智能編碼助手的行列,讓創作者無需傳統的編程專業知識,即可將自然語言描述轉換為功能原型和應用程式。Figma Make 在測試階段原本只有高級「Full
評論 (21)
0/200
Figma 向所有用戶發佈 AI 驅動的應用程式生成工具
Figma Make 是今年初推出的創新提示應用程式開發平台,目前已正式退出測試版,並向所有使用者推出。這個突破性的工具加入了 Google 的 Gemini Code Assist 和 Microsoft 的 GitHub Copilot 等人工智能編碼助手的行列,讓創作者無需傳統的編程專業知識,即可將自然語言描述轉換為功能原型和應用程式。Figma Make 在測試階段原本只有高級「Full
評論 (21)
0/200
![HarryClark]() HarryClark
HarryClark
 2025-08-21 15:01:19
2025-08-21 15:01:19
AlphaFold 3 sounds like a game-changer! Predicting molecular interactions could speed up drug discovery big time. Curious how it stacks up against traditional lab methods. 🧬


 0
0
![PeterThomas]() PeterThomas
PeterThomas
 2025-08-17 07:01:00
2025-08-17 07:01:00
AlphaFold 3 sounds like a game-changer! Predicting molecular interactions with such precision could really speed up drug discovery. I'm curious how it stacks up against traditional lab methods in terms of cost and time. Anyone know? 🤔


 0
0
![JoseLewis]() JoseLewis
JoseLewis
 2025-08-14 19:00:59
2025-08-14 19:00:59
AlphaFold 3 sounds like a game-changer! Predicting molecular interactions could speed up drug discovery big time. Excited to see how it shapes medical breakthroughs! 🚀


 0
0
![ElijahCollins]() ElijahCollins
ElijahCollins
 2025-08-14 11:01:00
2025-08-14 11:01:00
AlphaFold 3 sounds like a game-changer! Predicting molecular interactions could speed up drug discovery big time. Curious how it stacks against human researchers—will it outsmart us or just make our coffee breaks longer? 😄


 0
0
![GregorySmith]() GregorySmith
GregorySmith
 2025-08-06 10:01:00
2025-08-06 10:01:00
AlphaFold 3 sounds like a game-changer! Predicting molecular interactions with such precision could unlock new frontiers in medicine. But I wonder, will this tech stay accessible to all researchers, or get locked behind paywalls? 🤔


 0
0
![BruceThomas]() BruceThomas
BruceThomas
 2025-08-01 14:08:50
2025-08-01 14:08:50
AlphaFold 3 sounds like a game-changer for science! Predicting molecular interactions could speed up drug discovery big time. Excited to see where this goes! 🚀


 0
0

自2020年推出以來,已有超過200萬研究人員使用Google DeepMind的AlphaFold 2預測蛋白質結構,助力疫苗開發與癌症治療等突破。該模型解決了困擾科學家半世紀以上的難題。但Google DeepMind團隊未止步於此;他們未沉醉於榮譽,而是捲起袖子開始研發AlphaFold 3。
由Google DeepMind與Isomorphic Labs於五月推出,AlphaFold 3更上一層樓。它不僅預測蛋白質摺疊,還能預測各種生命分子的結構與相互作用,包括DNA、RNA和配體——那些與蛋白質結合的微小分子。
「有了AlphaFold 2,我們在解決蛋白質摺疊難題上取得了巨大進展,但科學界已轉向更複雜的問題,」Google DeepMind研究科學家Jonas Adler解釋。「研究人員現在深入探討小分子如何結合,或RNA如何運作等AlphaFold 2無法勝任的領域。為了跟上生物學與化學的最新進展,我們需要一款能處理各種生物分子的工具。」
這裡的「一切」包括配體,因其構成約一半的藥物而至關重要。「在Isomorphic Labs,我們看到AlphaFold 3在理性藥物設計上的巨大潛力,我們已每天應用它,」Isomorphic Labs研究領導者Adrian Stecula說。「我們正在探索新小分子如何與新藥靶點結合,研究蛋白質與DNA、RNA的相互作用,以及化學調整如何影響蛋白質結構——新模型開啟了所有這些可能性。」
納入這些額外的分子類型意味著要處理更多的組合。「蛋白質相對簡單,只有20種標準氨基酸,」Jonas指出。「但小分子?它們無處不在,可能性無窮。它們極其多樣。」
「這就像是分子複合物的Google Maps,」Google DeepMind研究工程師Lindsay Willmore說。「即使你不是程式設計師,也只需複製貼上你的蛋白質、DNA、RNA或小分子序列,按下按鈕,等幾分鐘,就能得到結構以及信心度量,幫助你評估預測的準確性。」
為了讓AlphaFold 3適用於如此廣泛的生物分子,團隊擴展了訓練數據,包括DNA、RNA、小分子等。「我們想,『為什麼不利用數據集中幫助我們研究蛋白質的所有內容,看看能走多遠?』」Lindsay解釋。「結果,我們走得很遠。」
AlphaFold 3的關鍵變化在於生成結構的最後部分。AlphaFold 2使用了複雜的幾何模組,而AlphaFold 3改用基於擴散的簡單生成模型,類似於其他先進的圖像生成模型如Imagen。這一變化簡化了模型處理新型分子的方式。
然而,這一轉變帶來了新挑戰:擴散模型會錯誤地為實際上「無序」的蛋白質區域創建「有序」結構——就像試圖將一堆混亂的義大利麵整理成整齊的螺旋。
因此,團隊轉向AlphaFold 2,其擅長預測這些無序相互作用。「我們用AlphaFold 2的預測來訓練AlphaFold 3,教它識別和預測無序,」Lindsay說。
「我們有句話:『相信螺旋麵,拒絕直麵,』」Jonas笑著補充。
團隊期待看到AlphaFold 3在基因組學和藥物設計等領域的應用。「看到我們走了多遠,真是令人驚嘆,」Jonas說。「曾經困難的現在變得簡單,曾經不可能的現在觸手可及。仍有難題待解,但我們對AlphaFold 3能幫助我們實現的感到興奮。」
 Anthropic 解決 AI 產生盜版書籍的法律案件
Anthropic 已與美國作家就一宗重大版權糾紛達成和解,同意擬議的集體訴訟和解方案,以避免可能耗費巨資的審判。該協議於本週二在法庭文件中提交,源於該人工智能公司使用盜版文學作品訓練其 Claude 模型的指控。雖然此案源於作家 Andrea Bartz、Charles Graeber 和 Kirk Wallace Johnson 的訴訟,但和解細節仍然保密。他們於 2023 年提出訴訟,指控
Anthropic 解決 AI 產生盜版書籍的法律案件
Anthropic 已與美國作家就一宗重大版權糾紛達成和解,同意擬議的集體訴訟和解方案,以避免可能耗費巨資的審判。該協議於本週二在法庭文件中提交,源於該人工智能公司使用盜版文學作品訓練其 Claude 模型的指控。雖然此案源於作家 Andrea Bartz、Charles Graeber 和 Kirk Wallace Johnson 的訴訟,但和解細節仍然保密。他們於 2023 年提出訴訟,指控
 Figma 向所有用戶發佈 AI 驅動的應用程式生成工具
Figma Make 是今年初推出的創新提示應用程式開發平台,目前已正式退出測試版,並向所有使用者推出。這個突破性的工具加入了 Google 的 Gemini Code Assist 和 Microsoft 的 GitHub Copilot 等人工智能編碼助手的行列,讓創作者無需傳統的編程專業知識,即可將自然語言描述轉換為功能原型和應用程式。Figma Make 在測試階段原本只有高級「Full
Figma 向所有用戶發佈 AI 驅動的應用程式生成工具
Figma Make 是今年初推出的創新提示應用程式開發平台,目前已正式退出測試版,並向所有使用者推出。這個突破性的工具加入了 Google 的 Gemini Code Assist 和 Microsoft 的 GitHub Copilot 等人工智能編碼助手的行列,讓創作者無需傳統的編程專業知識,即可將自然語言描述轉換為功能原型和應用程式。Figma Make 在測試階段原本只有高級「Full
 2025-08-21 15:01:19
2025-08-21 15:01:19
AlphaFold 3 sounds like a game-changer! Predicting molecular interactions could speed up drug discovery big time. Curious how it stacks up against traditional lab methods. 🧬


 0
0
 2025-08-17 07:01:00
2025-08-17 07:01:00
AlphaFold 3 sounds like a game-changer! Predicting molecular interactions with such precision could really speed up drug discovery. I'm curious how it stacks up against traditional lab methods in terms of cost and time. Anyone know? 🤔


 0
0
 2025-08-14 19:00:59
2025-08-14 19:00:59
AlphaFold 3 sounds like a game-changer! Predicting molecular interactions could speed up drug discovery big time. Excited to see how it shapes medical breakthroughs! 🚀


 0
0
 2025-08-14 11:01:00
2025-08-14 11:01:00
AlphaFold 3 sounds like a game-changer! Predicting molecular interactions could speed up drug discovery big time. Curious how it stacks against human researchers—will it outsmart us or just make our coffee breaks longer? 😄


 0
0
 2025-08-06 10:01:00
2025-08-06 10:01:00
AlphaFold 3 sounds like a game-changer! Predicting molecular interactions with such precision could unlock new frontiers in medicine. But I wonder, will this tech stay accessible to all researchers, or get locked behind paywalls? 🤔


 0
0
 2025-08-01 14:08:50
2025-08-01 14:08:50
AlphaFold 3 sounds like a game-changer for science! Predicting molecular interactions could speed up drug discovery big time. Excited to see where this goes! 🚀


 0
0