“ Alphafold 3:革新分子结构和相互作用预测”
自2020年推出以来,超过200万研究人员使用Google DeepMind的AlphaFold 2预测蛋白质结构,助力疫苗开发和癌症治疗等突破。该模型解决了半个多世纪以来困扰科学家的难题。但Google DeepMind团队并未止步;他们没有满足于已有成就,而是卷起袖子开始研发AlphaFold 3。
Google DeepMind和Isomorphic Labs于五月推出AlphaFold 3,进一步提升了性能。它不仅预测蛋白质折叠,还能预测DNA、RNA和配体等生命分子结构及其相互作用,配体是附着在蛋白质上的小分子。
“AlphaFold 2在解决蛋白质折叠难题上取得了巨大进展,但科学界已转向更复杂的问题,”Google DeepMind研究科学家Jonas Adler解释说。“研究人员现在深入研究小分子如何结合、RNA如何工作等领域,这些是AlphaFold 2的短板。为了跟上生物学和化学的最新进展,我们需要一个能处理各种生物分子的工具。”
这里的“所有”包括配体,因其构成约一半的药物而至关重要。“在Isomorphic Labs,我们看到AlphaFold 3在理性药物设计中的巨大潜力,我们已每天使用它,”Isomorphic Labs研究负责人Adrian Stecula说。“我们探索新小分子如何与新药物靶点结合,研究蛋白质与DNA、RNA的相互作用,以及化学调整如何影响蛋白质结构——新模型开启了所有这些可能性。”
纳入这些额外分子类型意味着要处理更多组合。“蛋白质很简单,只有20种标准氨基酸,”Jonas指出。“但小分子?它们千差万别,可能性无穷,极其多样。”
意识到全面数据库不可行,团队推出了AlphaFold Server。这一免费工具让科学家输入自己的序列,AlphaFold生成分子复合物。自五月上线以来,已用于创建超过100万个结构。
“这就像分子复合物的Google Maps,”Google DeepMind研究工程师Lindsay Willmore说。“即使你不是程序员,也可以复制粘贴蛋白质、DNA、RNA或小分子序列,点击按钮,等待几分钟。你会得到结构及置信度指标,帮助评估预测的准确性。”
为使AlphaFold 3适应多种生物分子,团队扩展了训练数据,包括DNA、RNA、小分子等。“我们想,‘为什么不利用数据集中的所有内容来训练,看能走多远?’”Lindsay解释说。“结果,我们走得很远。”
AlphaFold 3的关键变化在于生成结构的最后部分。AlphaFold 2使用复杂的基于几何的模块,而AlphaFold 3切换到基于扩散的简单生成模型,类似于Imagen等高级图像生成模型。这一变化简化了处理新型分子方式。
然而,这一转变带来了新挑战:扩散模型会错误地为实际“无序”的蛋白质区域创建“有序”结构——想象试图将一堆杂乱的意大利面整理成整齐的螺旋。
因此,团队转向AlphaFold 2,它擅长预测这些无序相互作用。“我们用AlphaFold 2的预测来训练AlphaFold 3,教它识别和预测无序,”Lindsay说。
“我们有句谚语:‘相信螺旋面,拒绝意大利面,’”Jonas笑着补充道。
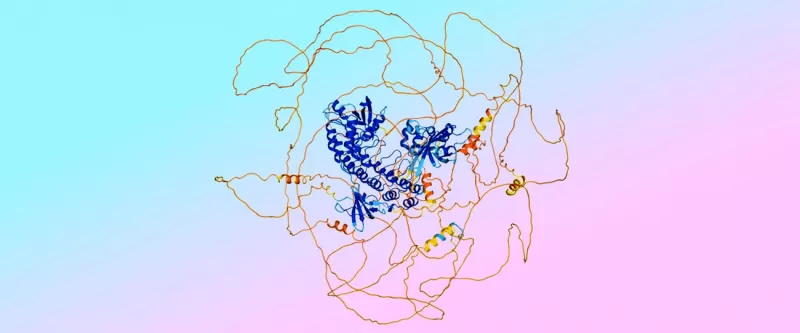
AlphaFold 3的预测示例,蓝色显示有序的“螺旋面”区域,橙色显示无序的“意大利面”区域。颜色表示模型对预测准确性的置信度。
团队对AlphaFold 3在基因组学和药物设计领域的应用感到兴奋。“看到我们走了多远真令人惊叹,”Jonas说。“曾经困难的现在变得简单,曾经不可能的现在触手可及。仍有难题待解,但我们对AlphaFold 3能帮助我们实现的目标感到激动。”
 "Dot AI伴侣应用程序宣布关闭,停止个性化服务
Dot 是一款人工智能伴侣应用程序,旨在充当个人朋友和知己,根据其开发者周五发布的公告,Dot 将停止运营。Dot背后的初创公司New Computer在其网站上表示,该服务将持续到10月5日,以便用户有时间导出个人数据。今年早些时候,联合创始人山姆-惠特莫尔(Sam Whitmore)和前苹果设计专家杰森-袁(Jason Yuan)合作推出了这款应用程序。Dot 进入了日益受到关注的情感人工智能
"Dot AI伴侣应用程序宣布关闭,停止个性化服务
Dot 是一款人工智能伴侣应用程序,旨在充当个人朋友和知己,根据其开发者周五发布的公告,Dot 将停止运营。Dot背后的初创公司New Computer在其网站上表示,该服务将持续到10月5日,以便用户有时间导出个人数据。今年早些时候,联合创始人山姆-惠特莫尔(Sam Whitmore)和前苹果设计专家杰森-袁(Jason Yuan)合作推出了这款应用程序。Dot 进入了日益受到关注的情感人工智能
 Anthropic 解决了人工智能生成盗版图书的法律案件
Anthropic公司与美国作家达成了一项重要的版权纠纷解决方案,同意拟议的集体诉讼和解,避免了可能代价高昂的审判。本周二在法庭文件中提交的这份协议源于对这家人工智能公司使用盗版文学作品训练克劳德模型的指控。尽管此案源于作家安德烈娅-巴茨(Andrea Bartz)、查尔斯-格雷伯(Charles Graeber)和柯克-华莱士-约翰逊(Kirk Wallace Johnson)的指控,但和解细节
Anthropic 解决了人工智能生成盗版图书的法律案件
Anthropic公司与美国作家达成了一项重要的版权纠纷解决方案,同意拟议的集体诉讼和解,避免了可能代价高昂的审判。本周二在法庭文件中提交的这份协议源于对这家人工智能公司使用盗版文学作品训练克劳德模型的指控。尽管此案源于作家安德烈娅-巴茨(Andrea Bartz)、查尔斯-格雷伯(Charles Graeber)和柯克-华莱士-约翰逊(Kirk Wallace Johnson)的指控,但和解细节
 Figma 向所有用户发布人工智能驱动的应用程序生成工具
Figma Make 是今年早些时候推出的创新型提示到应用开发平台,现已正式退出测试版,并向所有用户推出。这一开创性的工具加入了人工智能编码助手的行列,如谷歌的 Gemini Code Assist 和微软的 GitHub Copilot,使创作者能够将自然语言描述转化为功能原型和应用程序,而无需传统的编程专业知识。Figma Make 最初在测试阶段只对高级 "全席 "用户开放,现在对所有账户类
评论 (21)
0/200
Figma 向所有用户发布人工智能驱动的应用程序生成工具
Figma Make 是今年早些时候推出的创新型提示到应用开发平台,现已正式退出测试版,并向所有用户推出。这一开创性的工具加入了人工智能编码助手的行列,如谷歌的 Gemini Code Assist 和微软的 GitHub Copilot,使创作者能够将自然语言描述转化为功能原型和应用程序,而无需传统的编程专业知识。Figma Make 最初在测试阶段只对高级 "全席 "用户开放,现在对所有账户类
评论 (21)
0/200
![HarryClark]() HarryClark
HarryClark
 2025-08-21 15:01:19
2025-08-21 15:01:19
AlphaFold 3 sounds like a game-changer! Predicting molecular interactions could speed up drug discovery big time. Curious how it stacks up against traditional lab methods. 🧬


 0
0
![PeterThomas]() PeterThomas
PeterThomas
 2025-08-17 07:01:00
2025-08-17 07:01:00
AlphaFold 3 sounds like a game-changer! Predicting molecular interactions with such precision could really speed up drug discovery. I'm curious how it stacks up against traditional lab methods in terms of cost and time. Anyone know? 🤔


 0
0
![JoseLewis]() JoseLewis
JoseLewis
 2025-08-14 19:00:59
2025-08-14 19:00:59
AlphaFold 3 sounds like a game-changer! Predicting molecular interactions could speed up drug discovery big time. Excited to see how it shapes medical breakthroughs! 🚀


 0
0
![ElijahCollins]() ElijahCollins
ElijahCollins
 2025-08-14 11:01:00
2025-08-14 11:01:00
AlphaFold 3 sounds like a game-changer! Predicting molecular interactions could speed up drug discovery big time. Curious how it stacks against human researchers—will it outsmart us or just make our coffee breaks longer? 😄


 0
0
![GregorySmith]() GregorySmith
GregorySmith
 2025-08-06 10:01:00
2025-08-06 10:01:00
AlphaFold 3 sounds like a game-changer! Predicting molecular interactions with such precision could unlock new frontiers in medicine. But I wonder, will this tech stay accessible to all researchers, or get locked behind paywalls? 🤔


 0
0
![BruceThomas]() BruceThomas
BruceThomas
 2025-08-01 14:08:50
2025-08-01 14:08:50
AlphaFold 3 sounds like a game-changer for science! Predicting molecular interactions could speed up drug discovery big time. Excited to see where this goes! 🚀


 0
0

自2020年推出以来,超过200万研究人员使用Google DeepMind的AlphaFold 2预测蛋白质结构,助力疫苗开发和癌症治疗等突破。该模型解决了半个多世纪以来困扰科学家的难题。但Google DeepMind团队并未止步;他们没有满足于已有成就,而是卷起袖子开始研发AlphaFold 3。
Google DeepMind和Isomorphic Labs于五月推出AlphaFold 3,进一步提升了性能。它不仅预测蛋白质折叠,还能预测DNA、RNA和配体等生命分子结构及其相互作用,配体是附着在蛋白质上的小分子。
“AlphaFold 2在解决蛋白质折叠难题上取得了巨大进展,但科学界已转向更复杂的问题,”Google DeepMind研究科学家Jonas Adler解释说。“研究人员现在深入研究小分子如何结合、RNA如何工作等领域,这些是AlphaFold 2的短板。为了跟上生物学和化学的最新进展,我们需要一个能处理各种生物分子的工具。”
这里的“所有”包括配体,因其构成约一半的药物而至关重要。“在Isomorphic Labs,我们看到AlphaFold 3在理性药物设计中的巨大潜力,我们已每天使用它,”Isomorphic Labs研究负责人Adrian Stecula说。“我们探索新小分子如何与新药物靶点结合,研究蛋白质与DNA、RNA的相互作用,以及化学调整如何影响蛋白质结构——新模型开启了所有这些可能性。”
纳入这些额外分子类型意味着要处理更多组合。“蛋白质很简单,只有20种标准氨基酸,”Jonas指出。“但小分子?它们千差万别,可能性无穷,极其多样。”
“这就像分子复合物的Google Maps,”Google DeepMind研究工程师Lindsay Willmore说。“即使你不是程序员,也可以复制粘贴蛋白质、DNA、RNA或小分子序列,点击按钮,等待几分钟。你会得到结构及置信度指标,帮助评估预测的准确性。”
为使AlphaFold 3适应多种生物分子,团队扩展了训练数据,包括DNA、RNA、小分子等。“我们想,‘为什么不利用数据集中的所有内容来训练,看能走多远?’”Lindsay解释说。“结果,我们走得很远。”
AlphaFold 3的关键变化在于生成结构的最后部分。AlphaFold 2使用复杂的基于几何的模块,而AlphaFold 3切换到基于扩散的简单生成模型,类似于Imagen等高级图像生成模型。这一变化简化了处理新型分子方式。
然而,这一转变带来了新挑战:扩散模型会错误地为实际“无序”的蛋白质区域创建“有序”结构——想象试图将一堆杂乱的意大利面整理成整齐的螺旋。
因此,团队转向AlphaFold 2,它擅长预测这些无序相互作用。“我们用AlphaFold 2的预测来训练AlphaFold 3,教它识别和预测无序,”Lindsay说。
“我们有句谚语:‘相信螺旋面,拒绝意大利面,’”Jonas笑着补充道。
团队对AlphaFold 3在基因组学和药物设计领域的应用感到兴奋。“看到我们走了多远真令人惊叹,”Jonas说。“曾经困难的现在变得简单,曾经不可能的现在触手可及。仍有难题待解,但我们对AlphaFold 3能帮助我们实现的目标感到激动。”
 Anthropic 解决了人工智能生成盗版图书的法律案件
Anthropic公司与美国作家达成了一项重要的版权纠纷解决方案,同意拟议的集体诉讼和解,避免了可能代价高昂的审判。本周二在法庭文件中提交的这份协议源于对这家人工智能公司使用盗版文学作品训练克劳德模型的指控。尽管此案源于作家安德烈娅-巴茨(Andrea Bartz)、查尔斯-格雷伯(Charles Graeber)和柯克-华莱士-约翰逊(Kirk Wallace Johnson)的指控,但和解细节
Anthropic 解决了人工智能生成盗版图书的法律案件
Anthropic公司与美国作家达成了一项重要的版权纠纷解决方案,同意拟议的集体诉讼和解,避免了可能代价高昂的审判。本周二在法庭文件中提交的这份协议源于对这家人工智能公司使用盗版文学作品训练克劳德模型的指控。尽管此案源于作家安德烈娅-巴茨(Andrea Bartz)、查尔斯-格雷伯(Charles Graeber)和柯克-华莱士-约翰逊(Kirk Wallace Johnson)的指控,但和解细节
 Figma 向所有用户发布人工智能驱动的应用程序生成工具
Figma Make 是今年早些时候推出的创新型提示到应用开发平台,现已正式退出测试版,并向所有用户推出。这一开创性的工具加入了人工智能编码助手的行列,如谷歌的 Gemini Code Assist 和微软的 GitHub Copilot,使创作者能够将自然语言描述转化为功能原型和应用程序,而无需传统的编程专业知识。Figma Make 最初在测试阶段只对高级 "全席 "用户开放,现在对所有账户类
Figma 向所有用户发布人工智能驱动的应用程序生成工具
Figma Make 是今年早些时候推出的创新型提示到应用开发平台,现已正式退出测试版,并向所有用户推出。这一开创性的工具加入了人工智能编码助手的行列,如谷歌的 Gemini Code Assist 和微软的 GitHub Copilot,使创作者能够将自然语言描述转化为功能原型和应用程序,而无需传统的编程专业知识。Figma Make 最初在测试阶段只对高级 "全席 "用户开放,现在对所有账户类
 2025-08-21 15:01:19
2025-08-21 15:01:19
AlphaFold 3 sounds like a game-changer! Predicting molecular interactions could speed up drug discovery big time. Curious how it stacks up against traditional lab methods. 🧬


 0
0
 2025-08-17 07:01:00
2025-08-17 07:01:00
AlphaFold 3 sounds like a game-changer! Predicting molecular interactions with such precision could really speed up drug discovery. I'm curious how it stacks up against traditional lab methods in terms of cost and time. Anyone know? 🤔


 0
0
 2025-08-14 19:00:59
2025-08-14 19:00:59
AlphaFold 3 sounds like a game-changer! Predicting molecular interactions could speed up drug discovery big time. Excited to see how it shapes medical breakthroughs! 🚀


 0
0
 2025-08-14 11:01:00
2025-08-14 11:01:00
AlphaFold 3 sounds like a game-changer! Predicting molecular interactions could speed up drug discovery big time. Curious how it stacks against human researchers—will it outsmart us or just make our coffee breaks longer? 😄


 0
0
 2025-08-06 10:01:00
2025-08-06 10:01:00
AlphaFold 3 sounds like a game-changer! Predicting molecular interactions with such precision could unlock new frontiers in medicine. But I wonder, will this tech stay accessible to all researchers, or get locked behind paywalls? 🤔


 0
0
 2025-08-01 14:08:50
2025-08-01 14:08:50
AlphaFold 3 sounds like a game-changer for science! Predicting molecular interactions could speed up drug discovery big time. Excited to see where this goes! 🚀


 0
0